來源:網絡資源 2023-08-12 20:31:41
1.除去食鹽水中的CaCl2和Na2SO4雜質的操作有:①加過量的BaCl2溶液;②過濾;③加過量的Na2CO3溶液;④蒸發結晶;⑤加適量鹽酸。下列操作順序正確的是(提示BaSO4、BaCO3難溶于水) (D)
A.③①②⑤④B.①⑤③②④
C.①③⑤④②D.①③②⑤④
解析:粗鹽提純操作順序題需牢記兩點:①先加BaCl2溶液再加Na2CO3溶液;②先過濾后加稀鹽酸。
2.氯化鈉溶液中含有雜質CaCl2和Na2SO4,依次通過以下操作將其除去①加入過量的氯化鋇溶液;②加入過量的碳酸鈉溶液;③過濾;④加入適量的鹽酸至溶液呈中性。則關于該過程的說法正確的是(D)
A.操作①和②的順序可以顛倒
B.操作②只除去了Ca2+
C.操作③和④的順序可以顛倒
D.操作④只除去了CO32-
解析:必須將BaCl2溶液放在Na2CO3溶液之前加入,因為加入Na2CO3溶液需要同時除去Ca2+、Ba2+;A、B不正確。
加入稀鹽酸是為了除去CO32-,如果先加稀鹽酸再過濾,就會發生如下反應:BaCO3+2HCl=BaCl2+H20+CO2↑;CaCO3+2HCl=CaCl2+H20+CO2↑;反復引入雜質。
3.食鹽水中含有雜質CaCl2和Na2SO4,依次加入過量BaCl2和Na2CO3溶液后過濾,濾液中溶質為 ;過濾所用玻璃儀器有燒杯、玻璃棒和 。向食鹽水中通NH3和CO2可制得小蘇打和一種氮肥,該氮肥的化學式為 。(提示:BaSO4、BaCO3難溶于水)
解析:根據過量BaCl2能與Na2SO4溶液反應生成硫酸鋇沉淀和氯化鈉,過量Na2C03溶液能與氯化鈣、氯化鋇溶液反應生成碳酸鈣沉淀、碳酸鋇沉淀和氯化鈉,過濾,濾液中溶質為氯化鈉和碳酸鈉(過量的)。
過濾所用玻璃儀器有燒杯、玻璃棒和漏斗。
向食鹽水中通NH3和CO2可制得小蘇打和一種氮肥,由質量守恒定律,反應前后元素的種類不變,該氮肥中含有氮元素和氯元素,應為氯化銨,其化學式為:NH4Cl。
4.除去NaCl溶液中CaCl2、MgCl2、Na2SO4雜質的操作有:①加入過量的NaOH溶液,②加入過量的BaCl2溶液,③過濾,④加適量的鹽酸;⑤加過量的Na2CO3溶液。
(1)以上操作合理的先后順序為 (數字序號不能重復使用)。
(2)請寫出BaCl2溶液與Na2CO3溶液反應的化學方程式。
答: 。
(3)上述試劑中的Na2CO3不能用K2CO3代替,請說明原因。
答: 。
解析:粗鹽提純操作順序題需牢記兩點:①先加BaCl2溶液再加Na2CO3溶液;②先過濾后加稀鹽酸;所以順序可以為:①②⑤③④、②①⑤③④或②⑤①③④
BaCl2溶液與Na2CO3溶液反應的化學方程式:BaCl2+Na2CO3=BaCO3↓+2NaCl
粗鹽提純問題是除雜的具體化,除雜需要滿足不增不減易分離,如果用K2CO3代替Na2CO3就會生成氯化鉀,也是雜質。因此可以回答:避免引入新雜質氯化鉀(或K+)
5.粗鹽中含有的雜質有CaCl2、MgCl2、Na2SO4和泥沙,為除去雜質得到精鹽,加水溶解后可按以下順序操作:①加過量的NaOH溶液;②加過量的BaCl2溶液;③加過量的Na2CO3溶液;④過濾;⑤加足量的鹽酸;⑥蒸發結晶。
(1)寫出除去Na2SO4的化學方程式 。
(2)以上操作中一共發生 個反應。
解析:
整個粗鹽提純過程發生反應的化學方程式有:
①BaCl2+Na2SO4=2NaCl+BaSO4↓
②MgCl2+2NaOH=2NaCl+Mg(OH)2↓③CaCl2+Na2CO3=2NaCl+CaCO3↓④BaCl2+Na2CO3=2NaCl+BaCO3↓⑤2HCl+Na2CO3=2NaCl+H2O+CO2↑⑥HCl+NaOH=NaCl+H2O
6.為除去氯化鈉中的泥沙和CaCl2、MgCl2、Na2SO4雜質,某化學興趣小組的同學先將粗鹽樣品溶解、過濾,除去泥沙后,取粗鹽水按以下流程進行實驗探究。
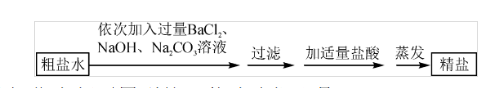
(1)溶解、過濾、蒸發操作中都要用到的一種玻璃儀器是 。
(2)寫出一個加入Na2CO3溶液時所發生反應的化學方程式 。
(3)上述流程中,若將過濾和加鹽酸的操作順序顛倒,所得精鹽產品中含哪些雜質?(BaSO4不溶于水,也不溶于酸)
答: 。
解析:
溶解、過濾、蒸發操作中都要用到玻璃棒,作用分別是:攪拌以加速溶解、引流以防止濾液飛濺、攪拌以防止局部溫度過高導致液體飛濺。
加入Na2CO3溶液的作用是同時除去Ca2+、Ba2+,因此反應方程式可以填寫:Na2CO3+CaCl2=CaCO3↓+2NaCl或BaCl2+Na2CO3= BaCO3↓+2NaCl。
如果先加稀鹽酸再過濾,就會發生如下反應:
BaCO3+2HCl=BaCl2+H20+CO2↑;
CaCO3+2HCl=CaCl2+H20+CO2↑;
Mg(OH)2+2HCl=MgCl2+2H2O;
因此所得精鹽產品中雜質有CaCl2、MgCl2、BaCl2
7.“粗鹽提純”指除去NaCl中的泥沙和MgCl2、CaCl2、Na2SO4等雜質。某同學設計了除去三種可溶性雜質的實驗方案:先將固體溶解,然后向其中依次加入過量的BaCl2、NaOH、Na2CO3溶液,充分反應后過濾,蒸發結晶。請回答:
部分物質的溶解性表(室溫)
|
OH- |
Cl- |
SO4 |
CO32- | |
|
H+ |
溶、揮 |
溶 |
溶、揮 |
|
|
Ba2+ |
溶 |
溶 |
不溶 |
不溶 |
|
Ca2+ |
微溶 |
溶 |
微溶 |
不溶 |
|
Mg2+ |
不溶 |
溶 |
溶 |
微溶 |
(1)溶解、過濾和蒸發操作中都用到一種玻璃儀器,該儀器在蒸發操作中的作用是什么?
答: 。
(2)加入Na2CO3溶液的目的是什么?
答: 。
(3)以上方案還需完善,請說明原因并加以補充。
答:
解析:
溶解、過濾、蒸發操作中都要用到玻璃棒,作用分別是:攪拌以加速溶解、引流以防止濾液飛濺、攪拌以防止局部溫度過高導致液體飛濺。
當過濾之后,我們會發現濾液里邊還有剛才除雜加入的過量的氫氧化鈉和碳酸鈉,所以必須除去。由于在操作過程中加入的試劑均過量,因此過濾后的濾液中除了含有氯化鈉外,還含有過量的碳酸鈉和氫氧化鈉;應該在濾液中加入適量的鹽酸再進行蒸發操作。
8.粗鹽中除主要成分NaCl外常含有少量的MgCl2、CaCl2、MgSO4雜質,某同學先將粗鹽配制成溶液,然后從碳酸鈉溶液、稀鹽酸、硝酸鋇溶液、碳酸鉀溶液和氫氧化鋇溶液中選擇三種試劑,按以下步驟進行實驗除去此粗鹽中雜質得到較為純凈的NaCl溶液:
實驗Ⅰ:向溶液中加入過量氫氧化鋇溶液后過濾,得濾液1;
實驗Ⅱ:向濾液1中加過量A后過濾,得濾液2;
實驗Ⅲ:向濾液2中滴加適量B,得到較純凈的NaCl溶液.
請回答下列問題:
(1)實驗Ⅰ中,所加氫氧化鋇溶液要過量的原因是 ;
(2)實驗Ⅱ中,有關化學方程式為 ;
(3)B試劑中溶質的化學式為 ;
(4)實驗Ⅲ中,試劑加到 時為適量,此時得到較為純凈的NaCl溶液。
解析:
(1)實驗Ⅰ中,所加氫氧化鋇溶液可以與MgCl2、CaCl2、MgSO4三種雜質中的MgCl2和MgSO4反應,因此所加氫氧化鋇溶液要過量的原因是:能除盡氯化鎂、硫酸鎂(使氯化鎂、硫酸鎂完全反應)。
(2)實驗Ⅱ中,碳酸鈉能和氯化鋇反應生成碳酸鋇沉淀和氯化鈉,能和氫氧化鋇反應生成碳酸鋇沉淀和氫氧化鈉,能和氯化鈣反應生成碳酸鈣沉淀和氯化鈉,反應的化學方程式分別是:BaCl2+Na2CO3═BaCO3↓+2NaCl,Na2CO3+Ba(OH)2═BaCO3↓+2NaOH,Na2CO3+CaCl2═CaCO3↓+2NaCl。
(3)B試劑是稀鹽酸,其中溶質氯化氫的化學式為HCl.
(4)實驗Ⅲ中,試劑加到剛好不產生氣泡時為適量,因為此時溶液中的氫氧化鈉和碳酸鈉和稀鹽酸恰好完全反應,得到較為純凈的NaCl溶液。
編輯推薦:

歡迎使用手機、平板等移動設備訪問中考網,2023中考一路陪伴同行!>>點擊查看